Innhold
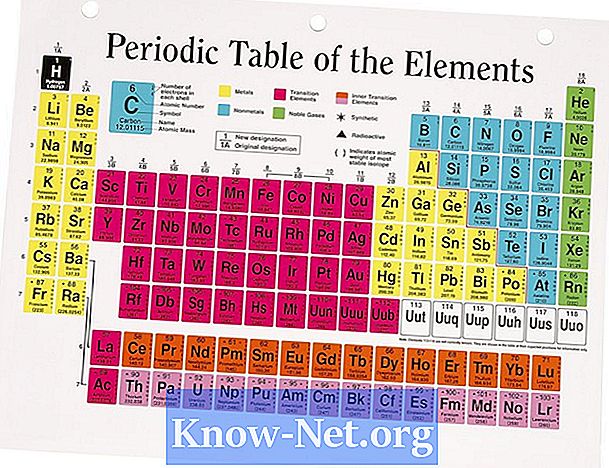
De fleste elementene finnes i naturen i form av mer enn en isotop. Overfloden av naturlig forekommende isotoper påvirker elementets gjennomsnittlige atommasse. Atommassen som finnes i det periodiske tabellen er gjennomsnittet av verdiene til de forskjellige isotoper som tar hensyn til overfloden av hver av dem. For elementer som kun har en isotop, er atommassen nær forventet verdi basert på antall protoner og nøytroner i kjernen.
retninger
-
Se mulig isotop av elementet av interesse. Alle elementer har en isotop på et minimum. For å beregne gjennomsnittlig atommasse må du vite hvor mange isotoper det er, deres overflod og deres atommasser.
-
Finn den naturlige overflaten av hver isotop, og noter disse verdiene med elementets isotopiske nummer.
-
Beregn atommassen ved å bruke et veid gjennomsnitt. Multipliser hver isotop med sin prosentvise overflod og legg opp alle verdier. For eksempel har magnesium tre isotoper: Mg (24), Mg (25) og Mg (26), hvis prosentandel er 78,9%, 10% og 11,1% og hvis masser er 23.985, 24.986 og 25.983, henholdsvis. Den vektede gjennomsnitt beregnes ut fra formelen (prosent 1 x atommasse) + (prosent 2 x atommasse) + (prosent 3 x atommasse) = (0,789 x 23,985) + (0,1 x 24,986) + (0,111 x 25.983) = 18.924 + 2.499 + 2.884 = 24.307. Den publiserte verdien er 24 305. Avrundingen av verdiene begrunner den lille forskjellen.
Hva du trenger
- Isotoper av elementet
- Prosentandel


